Therapie der chronischen Herzinsuffizienz
- Autor(en): Micha T. Maeder
- pharma-kritik-Jahrgang 40
, Nummer 10, PK1062
Redaktionsschluss: 19. März 2019
DOI: https://doi.org/10.37667/pk.2018.1062 - PDF-Download der Printversion dieser pharma-kritik Nummer
Der medikamentösen Therapie der Herzinsuffizienz war letztmals 2003 eine pharma-kritik-Nummer gewidmet. Der vorliegende Text fasst die heute aktuellen Empfehlungen zusammen.
Grundlagen
Eine korrekte Diagnostik ist unabdingbare Voraussetzung für eine adäquate und differenzierte Therapie der Herzinsuffizienz. Deshalb ist primär die Suche nach der Möglichkeit eines kausalen bzw. mechanischen Therapieansatzes (z.B. Klappenersatz/-rekonstruktion, Revaskularisation, Behandlung einer Rhythmusstörung) sehr wichtig. Falls dies nicht möglich ist, ist die Behandlung primär medikamentös. Der vorliegende Text befasst sich in erster Linie mit der Herzinsuffizienz mit reduzierter linksventrikulärer Auswurffraktion («Heart Failure with reduced [left ventricular] ejection fraction», HFrEF, Abkürzungen siehe Tabelle 1). Diese ist neben der Anamnese und den klinischen Zeichen definitionsgemäss durch eine linksventrikuläre Auswurffraktion von weniger als 40% gekennzeichnet.
Eine Herzinsuffizienz kann sich auch bei erhaltener linksventrikulärer Auswurffraktion (über 50%, «Heart Failure with preserved [left ventricular] ejection fraction», HFpEF) manifestieren. Zur Diagnose dienen dabei zusätzliche Kriterien, nämlich ein erhöhter BNP-Wert (über 35 ng/l, bzw. NT-proBNP <125 ng/l) und ein weiteres Zeichen (eine linksventrikuläre Hypertrophie oder linksatriale Dilatation bzw. eine diastolische Dysfunktion).
2016 wurde zusätzlich eine Herzinsuffizienzform mit «intermediären» Werten der linksventrikulären Auswurffraktion eingeführt, gekennzeichnet durch LVEF-Werte zwischen 40 und 50% und ausserdem durch die für die HFpEF gültigen Zusatzkriterien.(1) Diese wird als HFmrEF bezeichnet. So soll künftig die bisherige Unsicherheit beseitigt werden, ob Personen mit grenzwertiger LVEF eher gemäss den Empfehlungen für HFrEF oder für HFpEF zu behandeln sind.
Aus klinischer Sicht kann die Herzinsuffizienz gemäss der Klassifikation der New York Heart Association (NYHA) in vier Klassen eingeteilt werden (siehe Tabelle 2).
Therapie der Herzinsuffizienz mit erniedrigter Auswurffraktion (HFrEF)
Allgemeine Massnahmen
Die Behandlung der chronischen Herzinsuffizienz zielt darauf ab, Symptome zu lindern, die Leistungstoleranz zu verbessern, die Häufigkeit akuter Dekompensationen zu vermindern und die Sterblichkeit zu senken. Folgende allgemeine Massnahmen sind für alle Patientinnen und Patienten sinnvoll: Gewichtskontrolle, Flüssigkeitsrestriktion, Ausdauertraining, Nikotinabstinenz, minimaler bis kein Alkoholkonsum, Vermeiden einer exzessiven Kochsalzzufuhr, jährliche Grippeimpfung und Pneumokokkenimpfung alle sieben Jahre.
Therapie-Algorithmus der Europäischen Gesellschaft für Kardiologie (ESC)
ACE-Hemmer, Betablocker und Angiotensin-Rezeptorblocker (Sartane) antagonisieren die hochregulierten, zur Krankheitsprogression führenden Systeme (Renin-Angiotensin-Aldosteron-System und sympathisches Nervensystem) im Sinne einer «neurohumoralen Blockade» und führen zu einem «reversen Remodeling» (Regredienz der pathologischen linksventrikulären Dilatation/Dysfunktion).
In den aktuellen Richtlinien der ESC wird empfohlen, bei symptomatischer HFrEF die Behandlung mit einem ACE-Hemmer und einem Betablocker zu beginnen (Auftitrieren bis zur höchsten verträglichen Dosis). Bei fortbestehenden Symptomen und LVEF ≤35% wird ein Mineralokortikoid-Rezeptorantagonist (MRA, Aldosteronantagonist) hinzugefügt.(2)
Falls die Symptomatik unter ACE-Hemmer, Betablocker und MRA in optimalen Dosierungen fortbesteht, kann ein Ausbau der Therapie die Prognose verbessern. Dafür gibt es drei Optionen: den Angiotensin-Rezeptor-Neprilysin-Inhibitor (ARNI) Sacubitril/Valsartan (Entresto®), den If-Kanal-Hemmer Ivabradin (Procorolan®) und/oder die kardiale Resynchronisationstherapie. Diese Behandlungen können und sollen (falls die Indikation nach Etablieren einer der drei anderen Therapien noch fortbesteht) im Verlauf kombiniert werden.
Auf die kardiale Resynchronisationstherapie wird in diesem Artikel nicht weiter eingegangen; in gut ausgewählten Fällen ist sie aber eine sehr wirksame Behandlungsmöglichkeit. Ebenso sollte in dieser Situation die Implantation eines Defibrillators zur Prävention des plötzlichen Herztodes evaluiert werden.
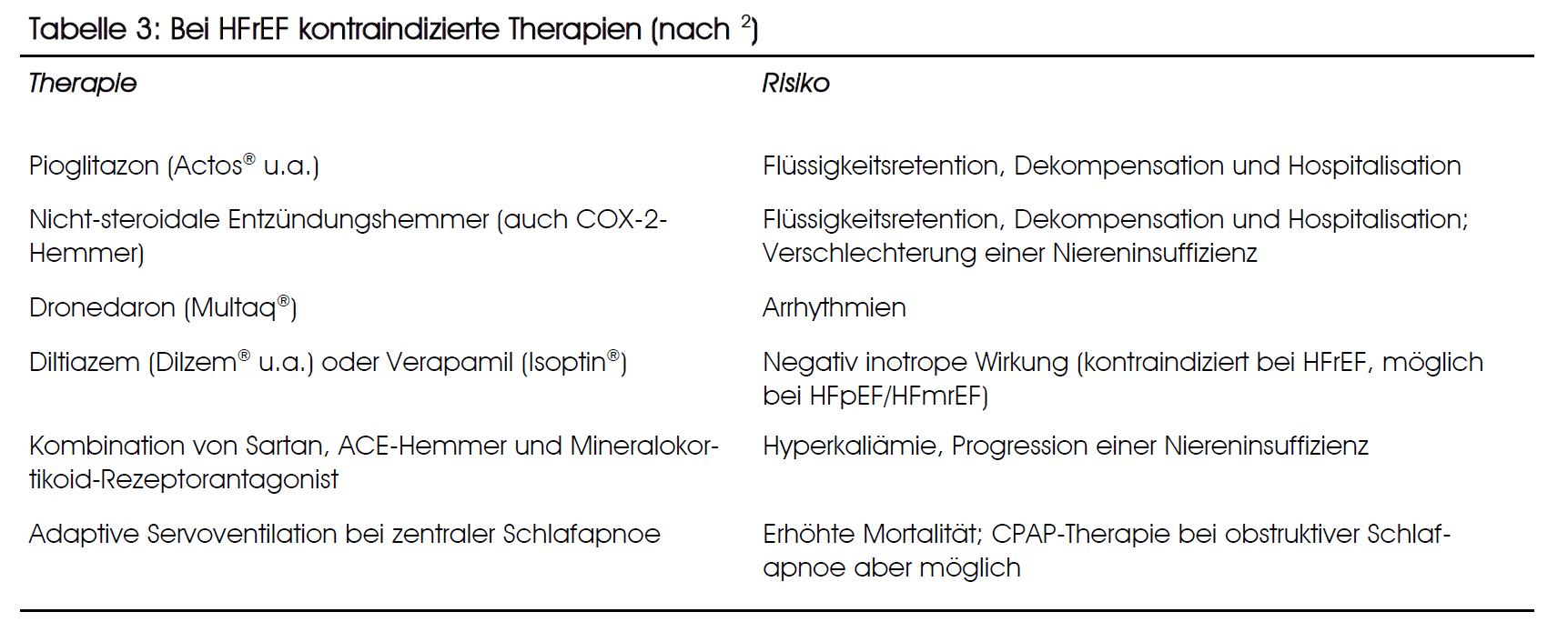
Therapien, die vermieden werden sollten, sind in Tabelle 3 zusammengestellt.
Diuretika
Schleifendiuretika korrigieren die Wasserretention und damit Dyspnoe und Ödeme rasch und wirksam; sie haben aber keinen nachgewiesenen prognostischen Nutzen. Hohe Schleifendiuretika-Dosen gehen bei chronischer Herzinsuffizienz mit einer ungünstigen Prognose einher; dies ist aber zumindest zum Teil dadurch erklärt, dass ein hoher Diuretika-Bedarf ein Zeichen für den Schweregrad der Herzinsuffizienz ist. Grundsätzlich sollte jeweils die minimal nötige Dosis eines Schleifendiuretikums angestrebt werden, damit die prognostisch relevanten Medikamente mit blutdrucksenkendem Effekt besser toleriert werden. Da Furosemid (Lasix® u.a.) gastro-intestinal sehr variabel resorbiert wird, hat sich heute Torasemid (Torem® u.a.) in vielen Ländern durchgesetzt. Ob sich das letztere aber prognostisch günstiger auswirkt, ist nicht nachgewiesen.(3)
Typische Nebenwirkungen der Schleifendiuretika sind eine Hypokaliämie und eine symptomatische Hypotonie bei Überbehandlung.
Bei therapierefraktären Ödemen kann ein zusätzliches Diuretikum wirksam sein; bei der Anwendung z.B. von Metolazon ist aber grosse Zurückhaltung (bzw. engmaschige Laborkontrollen) angezeigt, da es zu gefährlichen Elektrolytstörungen führen kann.
ACE-Hemmer
Ein ACE-Hemmer, titriert auf eine «Zieldosis» (oder die maximal verträgliche Dosis), bildet zusammen mit einem Betablocker die Behandlungsgrundlage für alle Kranken mit einer HFrEF. In der SOLVD-Studie, einer klassischen ACE-Hemmer-Studie, war die Behandlung mit Enalapril (Reniten® u.a.) gegenüber Placebo mit einer absoluten Mortalitätsreduktion von 4,5% über 41 Monate assoziiert.(4) Für andere ACE-Hemmer wurden vergleichbare Effekte gefunden. Die ACE-Hemmer sollen zuerst niedrig dosiert (z.B. Enalapril: initial 2,5 mg/Tag) und unter Kontrolle von klinischem Bild, Kreatinin und Kalium langsam gesteigert werden.
Personen ohne vorbestehende Hypertonie werden unter ACE-Hemmern oft hypoton, was per se (ohne Symptome) nicht zum Absetzen bzw. zur Dosisreduktion führen soll. Zu symptomatischen Hypotonien kommt es insbesondere bei Hypovolämie nach zu intensiver Vorbehandlung mit Schleifendiuretika. Entsprechend soll die Dosis des Schleifendiuretikums rechtzeitig reduziert werden.
Typische unerwünschte Wirkungen von ACE-Hemmern sind Hyperkaliämie und Verschlechterung einer Niereninsuffizienz. Bei gegen 20% der mit einem ACE-Hemmer Behandelten tritt ein Reizhusten auf. Ein Angioödem wird dagegen bei weniger als 1% beobachtet, wobei etwa die Hälfte aller Fälle innerhalb von 4 Wochen nach Therapiebeginn manifest werden.
Betablocker
Die Betablocker Bisoprolol (Concor® u.a.),(5) Metoprolol (Beloc ZOK®u.a.)(6) und Carvedilol (Dilatrend® u.a.)(7) hatten bei unterschiedlichen HFrEF-Populationen (NYHA II-IV) mit einer Basistherapie mit ACE-Hemmer und gegebenenfalls Diuretika eine sehr ähnliche Wirkung auf die Mortalität (absolute Risikoreduktion jeweils gut 4%). Für Nebivolol (z.B. Nebilet® u.a.) wurde eine ähnliche Wirkung bei älteren Personen mit HFrEF (≥70 Jahre) gezeigt. Betablocker sollen aber erst in stabilem Zustand (d.h. nicht im Rahmen der akuten Dekompensation) niedrig dosiert begonnen und ebenfalls langsam gesteigert werden.
Die Symptomatik kann sich unter Betablocker-Behandlung zunächst verschlechtern; initial überwiegen oft unerwünschte Wirkungen (Müdigkeit, Bradykardie, Schwäche, Schlafstörungen, Depression, Raynaud-Phänomen). Der prognostische Nutzen ist aber sehr gut belegt, weshalb der Einsatz eines Betablockers in einer möglichst hohen Dosierung bei jeder HFrEF-Behandlung angestrebt werden muss. Ein Asthma bronchiale ist eine Kontraindikation, eine chronisch-obstruktive Lungenkrankheuit (COPD) nicht. Ob zuerst ein ACE-Hemmer und dann ein Betablocker eingesetzt wird oder umgekehrt, spielt keine Rolle. Diese Fragestellung wurde in einer grossen Studie explizit untersucht.(8)
Mineralokortikoid-Rezeptorantagonisten (MRA)
Ein prognostischer Nutzen der MRA in Kombination mit einer Basis-Therapie aus ACE-Hemmer und Betablocker ist für das gesamte Symptomspektrum (NYHA II-IV) nachgewiesen. Daher sollten alle Betroffenen, die nach Etablieren eines ACE-Hemmers und eines Betablockers noch symptomatisch sind, mit einem MRA behandelt werden.
Für Spironolacton (Aldactone® u.a.) ist die Wirksamkeit bei Kranken mit ausgeprägten Symptomen (NYHA III/IV) gut nachgewiesen: in der RALES-Studie ergab sich unter Spironolacton im Zeitraum von 2 Jahren gegenüber Placebo eine Senkung der Mortalität um 30%.(9) Eplerenon (Inspra®), der neuere MRA, ist dagegen nur bei Personen mit geringeren Symptomen (NYHA II) dokumentiert.(10) Beide Medikamente haben ein erhebliches Hyperkaliämie-Risiko. Dies ist besonders bei gleichzeitiger Gabe eines ACE-Hemmers (oder Sartans) zu beachten. Für Eplerenon kommt noch die Möglichkeit weiterer pharmakokinetisch bedingter Interaktionen hinzu. Allerdings verursacht nur Spironolacton endokrine Nebenwirkungen – bei etwa 10% der mit diesem Mittel behandelten Männer kommt es zu einer Gynäkomastie. Im Alltag wird primär das kostengünstigere Spironolacton verwendet. In welchem Ausmass Eplerenon bei fortgeschrittener Herzinsuffizienz wirken kann, ist ungewiss.
Sartane (Angiotensin-Rezeptorblocker, ARB)
In einer median knapp 34 Monate dauernden Studie des CHARM-Programms reduzierte Candesartan (Atacand® u.a.) bei Personen, die ACE-Hemmer nicht vertragen hatten, im Vergleich zu Placebo die kardiovaskuläre Mortalität und Morbididät.(11) Für andere Sartane liegen keine vergleichbaren Daten zum Nutzen bei HFrEF vor. Entsprechend soll ein Sartan nicht primär, sondern nur bei echter ACE-Hemmer-Unverträglichkeit (z.B. aufgrund von Nebenwirkungen wie Husten) eingesetzt und ebenfalls in niedriger Dosis begonnen werden.
Typische unerwünschte Wirkungen von Sartanen umfassen Hyperkaliämie, Hypotonie und eine Verschlechterung der Nierenfunktion. Unter einer Behandlung mit Sartanen ist der unter ACE-Hemmern recht häufige Husten eindeutig seltener. Ein Angioödem ist unter Sartanen viel seltener als unter ACE-Hemmern, jedoch nicht völlig ausgeschlossen.
Die Kombination eines ACE-Hemmers mit einem Sartan ist nur ausnahmsweise eine Option, wenn aufgrund von unerwünschten Wirkungen kein MRA verwendet werden kann. Dabei ist allerdings eine sehr sorgfältige Überwachung der Nierenfunktion notwendig (bzw. ist die «duale» Hemmung bei erheblicher Niereninsuffizienz kontraindiziert). Es gibt allerdings bisher keine gute Evidenz, dass sich diese Kombination bei Herzinsuffizienz wirklich vorteilhaft auswirken würde. Dabei ist zu berücksichtigen, dass wohl die meisten Personen mit einer Herzinsuffizienz auch eine gewisse Niereninsuffizienz aufweisen und sich die letztere unter der Kombination mit grosser Wahrscheinlichkeit verschlechtert. Die Verwendung dieser Kombination zusammen mit einem kaliumsparenden Diuretikum oder mit einem MRA ist kontraindiziert.
Sacubitril/Valsartan
Sacubitril/Valsartan entspricht der Kombination eines Angiotensin-Rezeptorblockers mit einem Neprilysin-Inhibitor («ARNI»). Durch die Hemmung von Neprilysin mit Hemmung des Abbaus von BNPnimmt die vasodilatierende und natriuretische Wirkung von BNP zu. Untersucht wurde das Medikament bei Kranken, die unter der vorausgehenden Therapie mit einem ACE-Hemmer (oder Sartan) und einem Betablocker symptomatisch geblieben waren (NYHA ≥II), einen systolischen Blutdruck von mindestens 95-100 mm Hg und auch einen erhöhten Wert des BNP (oder NT-proBNP) aufwiesen. Bei solchen Patientinnen und Patienten war Sacubitril/Valsartan (2mal täglich 200 mg) in einer grossen Doppelblindstudie (PARADIGM-HF) dem ACE-Hemmer Enalapril (2mal täglich 10 mg) bezüglich Überleben und Rehospitalisationen signifikant überlegen. Die grosse Mehrzahl der Teilnehmenden hatte eine LVEF von höchstens 35%; sehr viele wurden auch mit Diuretika, über die Hälfte mit einem MRA und fast ein Drittel mit Digitalis-Präparaten behandelt. Aus den Resultaten zu den (vordefinierten) Subgruppen lassen sich keine sicheren Schlüsse ziehen; immerhin kann vermutet werden, dass jüngere, weniger symptomatische Personen (NYHA II) am meisten von Sacubitril/Valsartan profitieren.(12) Nach heutigem Wissensstand ist Sacubitril/Valsartan eine geeignete Therapie für Personen, die dem Profil der in der beschriebenen Studie Behandelten entsprechen. Sacubitril/Valsartan einzusetzen, bevor eine optimale Therapie mit einem ACE-Hemmer (bzw. allenfalls mit einem Sartan) durchgeführt wurde, ist nicht sinnvoll (und auch nicht Evidenz-gerecht).
Bei der Umstellung von einem ACE-Hemmer auf Sacubitril/Valsartan besteht ein erhöhtes Angioödem-Risiko; deshalb ist ein mindestens 36-stündiges Intervall nach dem Absetzen des ACE-Hemmers einzuhalten (gilt nicht für die Umstellung von einem Sartan auf Sacubitril/Valsartan). Zu beachten ist zudem, dass sich das BNP (im Gegensatz zu NT-proBNP) bei Therapie mit Sacubitril/Valsartan nicht mehr als Verlaufsparameter der Herzinsuffizienz eignet (ansteigende Werte).
Eine symptomatische Hypotonie ist unter Sacubitril/Valsartan häufiger (bei 14%) als unter Enalapril (9%). Andere unerwünschte Wirkungen sind eine Hyperkaliämie und eine Verschlechterung der Nierenfunktion – beides ähnlich häufig wie unter ACE-Hemmern. Husten ist seltener, ein Angioödem zwar selten, aber häufiger als unter Enalapril. Da Neprilysin am Abbau von Beta-Amyloid beteiligt ist, bestehen Bedenken, dass das Medikament das Demenzrisiko erhöhen könnte; die Resultate einer entsprechenden Studie, in der Auswirkungen auf neurokognitive Funktionen erfasst werden, sollen im Jahr 2022 vorliegen.
Ivabradin
Ivabradin, ein selektiver Hemmer des If-Kanals im Sinusknoten, wurde initial zur Behandlung der Angina pectoris eingeführt. Das Medikament senkt die Herzfrequenz ohne Auswirkungen auf die AV-Überleitung, die Kontraktilität und den Blutdruck. In einer Doppelblindstudie (SHIFT) erhielten Personen mit einer LVEF von ≤35%, die mit einem Betablocker, einem ACE-Hemmer (oder Sartan) und teilweise auch mit einem MRA vorbehandelt waren, Ivabradin (durchschnittlich zweimal täglich 6,5 mg (mit Dosisanpassung gemäss Herzfrequenz) oder Placebo. Nur Individuen mit einer Ruhe-Herzfrequenz von mindestens 70/min wurden aufgenommen. Über eine mediane Studiendauer von 23 Monaten wurde mit Ivabradin eine Reduktion des primären Endpunktes (Kombination von kardiovaskulärer Mortalität und Spitaleinweisungen wegen Herzinsuffizienz) erreicht. Die Mortalität allein wurde jedoch nicht signifikant beeinflusst.(13)
Unter den unerwünschten Wirkungen von Ivabradin sind in erster Linie Bradykardien, ein erhöhtes Risiko von Vorhofflimmern, Sehstörungen (Phosphäne) und allergische Reaktionen zu nennen. Gemäss verschiedenen Leitlinien ist Ivabradin bei Personen, die den SHIFT-Studienbedingungen entsprechen, als Zusatztherapie geeignet; kritische Stimmen halten das Nutzen/Risiko-Verhältnis von Ivabradin jedoch gesamthaft als ungünstig.
Weitere Medikamente
Digoxin, das klassische Herzglykosid, hat heute keinen definierten Stellenwert mehr in der Behandlung einer HFrEF. Bei Vorhofflimmern kann es zur Frequenz-Kontrolle eingesetzt werden. Ein prognostischer Nutzen ist in dieser Konstellation aber nicht nachgewiesen.
Parenteral verabreichte Eisen-Carboxymaltose (Ferinject®) hat in zwei Studien bei Personen mit HFrEF und Ferritinwerten unter 100 μg/l (oder Ferritin 100-300 μg/l bei Transferrin-Sättigung <20%) Vorteile bezüglich der Symptomatik (insbesondere eine Verbesserung der 6-Minuten-Gehstrecke) gezeigt. Entschliesst man sich zu dieser Anwendung, so ist zu bedenken, dass bisher keine Auswirkungen auf klinisch harte Endpunkte (Morbidität und Mortalität) dokumentiert sind.
Therapie der Herzinsuffizienz mit erhaltener Auswurffraktion (HfpEF)
Im Gegensatz zur Behandlung der HFrEF gibt es nach wie vor keine Therapie, die das Überleben von Patientinnen und Patienten mit HFpEF nachweislich verbessert. Nachfolgend sind Studienresultate der letzten beiden Dekaden zusammengefasst. Eine ausführlichere Darstellung findet sich in einer aktuellen Übersicht.(14)
Diuretika sind gemäss der Fachmeinung bei den durch HFpEF verursachten Stauungssymptomen klar indiziert. Es gibt aber dazu keine Evidenz aus randomisierten Studien. Aufgrund der Pathophysiologie des kleinen und steifen linken Ventrikels ist eine kleine Dosis eines Schleifendiuretikums symptomatisch oft sehr wirksam, kann aber auch schnell zu Überbehandlung mit symptomatischer Hypotonie führen. Diuretika sollen daher möglichst nur vorübergehend gemäss Volumenstatus eingesetzt werden.
Spironolacton ist derzeit das Medikament mit der besten Evidenz für die Behandlung der HFpEF. In zwei mechanistischen Studien wurden konsistente Effekte auf die diastolischen Eigenschaften des linken Ventrikels in Ruhe gefunden. Hinsichtlich Leistungsfähigkeit haben diese Studien keine übereinstimmenden Resultate erbracht. In einer randomisierten Studie ergab Spironolacton eine Senkung der Hospitalisationsrate. Einschränkend waren jedoch erhebliche regionale Unterschiede von Ereignisraten und Therapie-Effekten.(15)
ACE-Hemmer: In einer einzigen grossen Studie wurde ein ACE-Hemmer bei HFpEF untersucht; im Vergleich mit Placebo ergab sich aber für Perindopril (Coversum® u.a.) kein eindeutiger Nachweis eines Nutzens.(16)
Sartane: In den beiden grossen Studien, in denen Candesartan und Irbesartan (Aprovel® u.a.) mit Placebo verglichen wurden, fand sich bei HFpEF keine Senkung von Mortalität oder Rehospitalisationen.(17,18)
Betablocker sind wegen der Verlängerung der Diastolendauer theoretisch für die Behandlung der HFpEF geeignet. Die Datenlage hierzu ist allerdings sehr schmal. In der SENIORS-Studie fand sich zwar (in einer post hoc definierten Subgruppe) für Nebivolol bei Personen mit einer LVEF von über 40% eine günstige Wirkung bezüglich Tod oder Hospitalisationen; der Unterschied gegenüber Placebo war jedoch nicht signifikant.(19)
Verbesserung der Stickoxid-Verfügbarkeit: Ein lokaler Mangel an Stickoxid wird als Mechanismus sowohl der linksventrikulären diastolischen Dysfunktion als auch der abnormen pulmonal-vaskulären Hämodynamik bei HFpEF angesehen. Entsprechende Studien z.B. mit Isosorbid-Dinitrat oder mit den bei pulmonaler Hypertonie verwendeten Medikamenten (z.B. Sildenafil [Revatio®]) konnten aber bisher keine Wirkung auf klinisch relevante Endpunkte zeigen.
Weitere Medikamente: Andere Medikamente, die sich aufgrund theoretischer Erwägungen bei HFpEF vorteilhaft auswirken könnten (Diltiazem, Verapamil, Ivabradin, Digoxin), sind alle ungenügend dokumentiert.
Literatur
- 1) Mahtani KR et al. JAMA Intern Med 2018; 178: 1693-1700
- 2) Ponikowski P et al. Eur Heart J 2016; 37: 2129-200
- 3) Täger T et al. Int J Cardiol 2019 (online Feb 2)
- 4) SOLVD Investigators. N Engl J Med 1991; 325: 293-302
- 5) Anon. Lancet 1999; 353: 9-13
- 6) Anon. Lancet 1999; 353: 2001-7
- 7) Packer M et al. N Engl J Med 2001; 344: 1651-8
- 8) Willenheimer R et al. Circulation 2005; 112: 2426-35
- 9) Pitt B et al. N Engl J Med 1999; 341: 709-17
- 10) Zannad F et al. N Engl J Med 2011; 364: 11-21
- 11) Granger CB et al. Lancet 2003; 362: 772-6
- 12) McMurray JJ et al. N Engl J Med 2014; 371: 993-1004
- 13) Swedberg K et al. Lancet 2010; 376: 875-85
- 14) Maeder MT et al. Ther Umschau 2018; 75: 161-9
- 15) Pitt B et al. N Engl J Med 2014; 370: 1383-92
- 16) Cleland JGF et al. Eur Heart J 2006; 27: 2338-45
- 17) Yusuf S et al. Lancet 2003; 362: 777-81
- 18) Massie BM et al. N Engl J Med 2008; 359: 2456-67
- 19) Flather MD et al. Eur Heart J 2005; 26: 215-25
Standpunkte und Meinungen
- Es gibt zu diesem Artikel keine Leserkommentare.
Copyright © 2024 Infomed-Verlags-AG
PK1062
Verwandte Artikel
Gratisbuch bei einem Neuabo!
pharma-kritik abonnieren
-
Jahrgang 45 / 2023
Jahrgang 44 / 2022
Jahrgang 43 / 2021
Jahrgang 42 / 2020
Jahrgang 41 / 2019
Jahrgang 40 / 2018
Jahrgang 39 / 2017
Jahrgang 38 / 2016
Jahrgang 37 / 2015
Jahrgang 36 / 2014
Jahrgang 35 / 2013
Jahrgang 34 / 2012
Jahrgang 33 / 2011
Jahrgang 32 / 2010
Jahrgang 31 / 2009
Jahrgang 30 / 2008
Jahrgang 29 / 2007
Jahrgang 28 / 2006
Jahrgang 27 / 2005
Jahrgang 26 / 2004
Jahrgang 25 / 2003
Jahrgang 24 / 2002
Jahrgang 23 / 2001
Jahrgang 22 / 2000
Jahrgang 21 / 1999
Jahrgang 20 / 1998
Jahrgang 19 / 1997
Jahrgang 18 / 1996
Jahrgang 17 / 1995
Jahrgang 16 / 1994
Jahrgang 15 / 1993
Jahrgang 14 / 1992
Jahrgang 13 / 1991
Jahrgang 12 / 1990
Jahrgang 11 / 1989
Jahrgang 10 / 1988
Kennen Sie "100 wichtige Medikamente" schon?
Die Liste der 100 Medikamente sehen Sie auf der Startseite von 100 Medikamente.