Kardiotoxizität onkologischer Medikamente
- Autor(en): Urspeter Masche
- Reviewer: Thomas Kühne, Thorsten Langer, Thomas M. Suter
- pharma-kritik-Jahrgang 31
, Nummer 12, PK697
Redaktionsschluss: 9. April 2010
DOI: https://doi.org/10.37667/pk.2009.697 - PDF-Download der Printversion dieser pharma-kritik Nummer
Zu den unerwünschten Wirkungen, die durch die in der Onkologie verwendeten Medikamente hervorgerufen werden, gehören auch kardiovaskuläre Probleme. Es handelt sich einerseits um akute Nebenwirkungen (Arrhythmien, Blutdruckveränderungen, Thromboembolien u.a.), andererseits um chronische, die sich erst nach Abschluss der Chemotherapie manifestieren. In die zweite Kategorie fallen insbesondere kardiotoxische Effekte, die durch eine Schädigung des Herzmuskelgewebes gekennzeichnet sind und zur Herzinsuffizienz führen. Die Kardiotoxizität verdient als eine mögliche Langzeitfolge umso mehr Beachtung, da zum einen die Gruppe der Geheilten zunimmt, die selbst 10 bis 15 Jahre nach Therapieende noch davon betroffen sein können, zum anderen auch die Palette der kardiotoxischen Substanzen in der Onkologie immer grösser wird.
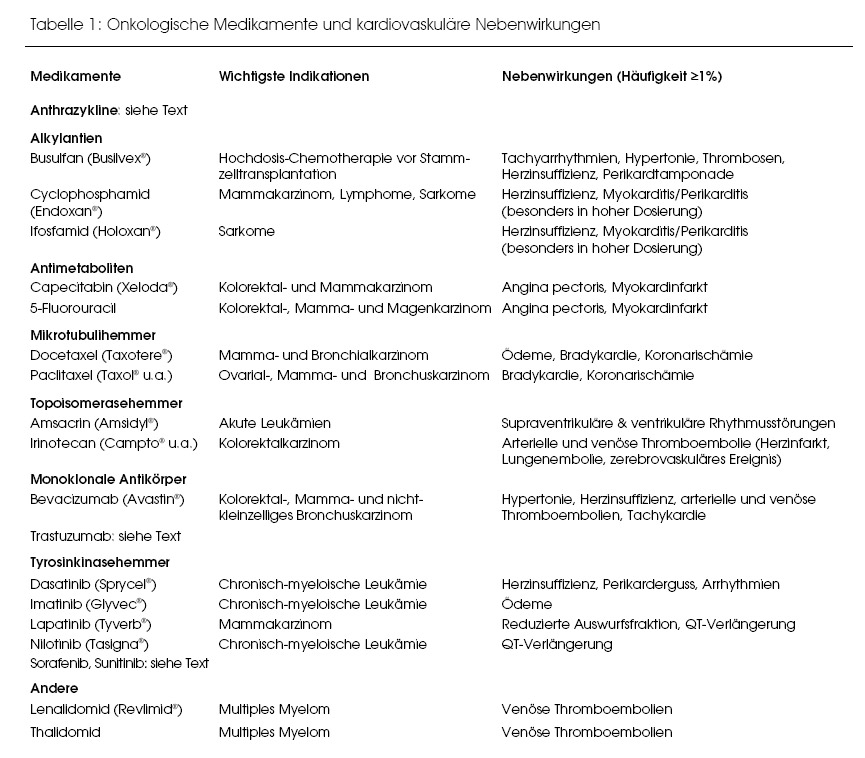
Als Inbegriff von kardiotoxischen Zytostatika gelten die Anthrazykline. Andere Medikamente, die gegen Krebserkrankungen eingesetzt werden, können aber ebenfalls Nebenwirkungen an Herz oder Gefässen verursachen. Tabelle 1 liefert eine Übersicht, bei welchen Substanzen kardiovaskuläre Nebenwirkungen beschrieben sind, deren Inzidenz bei mindestens 1% liegt. Diejenigen Medikamente, bei denen die kardialen Nebenwirkungen als ein wesentliches Problem hervorstechen, werden im Text erörtert.
Anthrazykline
Anthrazykline zählen zu den wirksamsten und wichtigsten Zytostatika. Als erste Vertreter wurden Doxorubicin (Adriblastin® u.a.) und Daunorubicin (Cerubidine®) in den 1960er-Jahren synthetisiert. Doxorubicin wird in erster Linie beim Mammakarzinom, bei aggressiven Lymphomen, bei Sarkomen und bei Krebserkrankungen von Kindern verwendet, Daunorubicin bei akuten Leukämien. Später sind weitere Anthrazykline dazugekommen: Epirubicin (Farmorubicin® u.a.) ist ein durch Epimerisierung gebildetes Stereoisomer von Doxorubicin und weist etwas andere pharmakokinetische Eigenschaften auf (z.B. raschere Elimination); in äquimolarer Menge ist es weniger kardiotoxisch als Doxorubicin; dieser Vorteil wird aber dadurch aufgehoben, dass Epirubicin für eine optimale zytostatische Wirkung höher dosiert wird als Doxorubicin. Idarubicin (Zavedos®) wurde aus Daunorubicin entwickelt und wirkt möglicherweise weniger kardiotoxisch; eindeutig geklärt ist dies indessen nicht. Ein mit den Anthrazyklinen chemisch verwandtes Zytostatikum ist das Anthrachinon-Derivat Mitoxantron (Novantron® u.a.), das in der Onkologie hauptsächlich als Zweitlinienmedikament dient und ebenfalls kardiotoxisch ist.(1-3)
Die Kardiotoxizität der Anthrazykline ist neben der Myelosuppression die dosislimitierende Nebenwirkung dieser Substanzgruppe. Die Anthrazyklin-induzierte Kardiotoxizität lässt sich in zwei Formen unterteilen. Die erste, (sub-) akute Form kann schon nach einmaliger Verabreichung auftreten und macht sich mit EKG-Veränderungen, Tachykardien, Arrhythmien, Linksherzinsuffizienz oder einem Perikarditis-Myokarditis-Syndrom bemerkbar. Diese Veränderungen sind dosisunabhängig, in den meisten Fällen harmlos und mit den gängigen Behandlungsschemen nicht mehr häufig.
Viel bedeutsamer ist die zweite, chronisch-progressive Form. Sie ist dosisabhängig und entwickelt sich meistens innerhalb eines Jahres, kann aber auch noch Jahre nach Abschluss einer Chemotherapie vorkommen. In der Regel äussert sie sich als dilatative Kardiomyopathie, die zu einer Linksherzinsuffizienz führt. Der Mechanismus der Anthrazyklin- bedingten Kardiotoxizität ist komplex. Ein wesentlicher Umstand scheint zu sein, dass beim Abbau der Anthrazykline zellschädigende freie Radikale entstehen, gegenüber denen die Herzmuskelzellen besonders empfindlich reagieren; letztlich resultiert ein Zelltod mit Myokardverlust. Bei der Radikalbildung sind Eisenionen beteiligt, die von der zwei- in die dreiwertige Form oxidiert werden.
Das Auftreten einer Kardiomyopathie hängt von der kumulativen Dosis des verabreichten Anthrazyklins ab. Bei Doxorubicin, dem am meisten verwendeten und bestuntersuchten Anthrazyklin, wird das Risiko einer Kardiomyopathie bei einer kumulativen Dosis von 300 mg/m² auf knapp 2% eingestuft, bei 400 mg/m² auf 5%, bei 500 mg/m² auf 16% und bei 700 mg/m² auf 48%.(4) Ein deutlicher Sprung findet bei 500 bis 550 mg/m² statt, so dass man empirisch 550 mg/m² als obere Grenze festgelegt hat (bei den anderen Anthrazyklinen sind andere Limiten formuliert). Es besteht aber eine grosse individuelle Variabilität; das heisst, zum Teil werden höhere Kumulativdosen gut toleriert, zum Teil können aber auch niedrigere Dosen zu einem klinisch manifesten Myokardschaden führen.
Man geht davon aus, dass die Anthrazyklin-induzierte Kardiotoxizität vor allem von den Plasmaspitzenspiegeln, die zytostatische Wirkung dagegen mehr von der Fläche unter der Konzentrations-Zeit-Kurve (AUC) abhängt. Bestätigt wird diese Theorie durch eine Cochrane-Übersicht, in der man zum Schluss kommt, dass das Risiko einer Herzinsuffizienz mit einer über mindestens 6 Stunden ausgedehnten Infusion gegenüber einer kürzeren Verabreichungsdauer signifikant vermindert wird. Nicht belegt werden konnte in dieser Metaanalyse hingegen, dass eine Reduktion der Bolusdosis das Herzinsuffizienz-Risiko senkt.(5) In der Praxis werden aber Anthrazykline nach wie vor in erster Linie als intravenöser Bolus alle drei bis vier Wochen verordnet, was dem mehrheitlich in den Studien verwendeten und auch praktikabelsten Schema entspricht. Wichtige Ausnahme bilden Kinder, bei denen man prolongierte Infusionen bevorzugt.
Neben der kumulativen Dosis und dem Dosierungsschema werden weitere Risikofaktoren mit der Kardiotoxizität in Zusammenhang gebracht. Dazu zählen das Alter und das Geschlecht (Kinder, über 65-Jährige bzw. Frauen scheinen ein höheres Risiko zu haben), eine vorbestehende Herzkrankheit, eine arterielle Hypertonie sowie eine zurückliegende oder laufende Bestrahlung im Bereich des Thorax.(6)
Bei Kindern fällt noch ins Gewicht, dass länger mit kardialen Spätfolgen zu rechnen ist als bei Erwachsenen.(7)
Einfluss anderer Zytostatika
Die kardiotoxischen Effekte von Anthrazyklinen können durch andere Zytostatika verstärkt werden. Eine solche Interaktion wurde bei Paclitaxel (Taxol® u.a.) und Doxorubicin festgestellt. Als primäre Ursache vermutet man das Lösungsmittel von Paclitaxel (polyethoxyliertes Rizinusöl = Cremophor®), das die Clearance von Doxorubicin und seiner kardiotoxischen Metaboliten vermindert, was zu einem Anstieg der Doxorubicin- Exposition um rund ein Drittel führen kann. Dieser Effekt kommt vor allem zum Tragen, wenn Paclitaxel und Doxorubicin unmittelbar nacheinander verabreicht werden.(8) Die Wechselwirkung ist auch zwischen Paclitaxel und Epirubicin zu erwarten.
Die Kombination eines Anthrazyklins mit Trastuzumab (Herceptin ®), das selbst kardiotoxisch wirkt (siehe unten), beinhaltet ebenfalls ein erhöhtes kardiales Risiko. Ferner ist bei Cyclophosphamid (Endoxan®) in hohen Dosen beschrieben, dass es die Kardiotoxizität von Doxorubicin fördert.
Prophylaxe und Überwachung
Primäre prophylaktische Massnahme ist es, die Personen zu identifizieren, bei denen ein erhöhtes Kardiotoxizitätsrisiko besteht. Nach Beginn der Behandlung gilt es, allfällige kardiotoxische Effekte möglichst rasch zu erfassen. Die vermutlich beste Untersuchung hierfür wäre die Endomyokardbiopsie, die aber als invasives Verfahren für den praktischen Alltag nicht geeignet ist. Als gängige Methode hat sich deshalb die Bestimmung der Auswurfsfraktion etabliert, die üblicherweise mit einer Echokardiographie durchgeführt wird. Die Auswurfsfraktion gibt die systolische Funktion wieder. Oft beginnt die linksventrikuläre Funktionsstörung indessen mit einer Abnahme der diastolischen Funktion. Deshalb wird man in Zukunft bei der Überwachung einer Anthrazyklin-Behandlung auch Geschwindigkeits- und Verformungsmessungen zum Beispiel mit Hilfe der Gewebe-Doppler-Methode miteinbeziehen. Bei gewissen Fragestellungen kann die kardiale Magnetresonanz- Tomographie ergänzende Informationen liefern. Das EKG wird als einfache Basisuntersuchung empfohlen, zumindest wenn eine vorbestehende Herzerkrankung vermutet wird. Eine Verlängerung der QT-Zeit ist möglicherweise ein Prädiktor eines kardiotoxischen Effekts, was indessen noch zu wenig systematisch untersucht wurde.(9) Ob Serummarker wie das Troponin oder das natriuretische Peptid (BNP, «brain natriuretic peptide») nützlich wären, ist ebenfalls nicht genau festgelegt.(2,9)
Übereinstimmende Richtlinien, wie eine Anthrazyklin-Behandlung kardiologisch zu kontrollieren sei, existieren nicht. Wenn die Auswurfsfraktion vor der Chemotherapie normal ausfällt, ist eine regelmässige Kontrolle angezeigt, sobald die Kumulativdosis ungefähr 50 bis 60% der empfohlenen Maximaldosis erreicht hat. Bei eingeschränkter Auswurfsfraktion ist individuell zu entscheiden, wie die Behandlung zu überwachen oder ob auf ein Anthrazyklin zu verzichten ist; bei einem Wert unter 30% sind Anthrazykline kontraindiziert. Wenn die Auswurfsfraktion unter der Therapie mit einem Anthrazyklin um ein bestimmtes Mass abnimmt, sollte die Anthrazyklin-Behandlung abgebrochen werden. Wie lange nach einer Anthrazyklin- Behandlung kardiologische Kontrollen fortgeführt werden sollen, ist ebenfalls nicht einheitlich festgelegt. Bei Kindern dürfte sicher eine über Jahre dauernde (eventuell sogar lebenslängliche) Nachsorge gerechtfertigt sein, mit einem speziellen Auge auf Situationen, in denen mit einer physiologischen Mehrbelastung des Herzens zu rechnen ist (intensive sportliche Tätigkeit, Schwangerschaft).(7)
Auch von medikamentöser Seite her gibt es Möglichkeiten, der Kardiotoxizität entgegenzuwirken. Alternative, vermutlich weniger toxische Verabreichungsschemen sind bereits erwähnt worden. Ein Medikament, das vor der Anthrazyklin-bedingten Kardiotoxizität schützen soll, ist Dexrazoxan. Diese Substanz (die in der Schweiz nicht erhältlich ist) wird im Körper zu einer offenen, EDTA-ähnlichen Ringstruktur hydrolysiert und fungiert als Chelator, der sich an intrazelluläres Eisen bindet und damit die Bildung freier Radikale vermindert (siehe oben). Gemäss einer Cochrane-Übersicht vermag Dexrazoxan das Risiko einer Herzinsuffizienz signifikant zu reduzieren. Zwar konnten ursprünglich geäusserte Vermutungen, dass Dexrazoxan das Ansprechen auf die Chemotherapie vermindere oder zu vermehrten Nebenwirkungen führe, in dieser Metaanalyse nicht bestätigt werden;(10) dennoch wird das Mittel von Fachleuten zurückhaltend bewertet. Eine andere Möglichkeit besteht darin, Anthrazykline in einer chemischen Form zu verabreichen, die weniger kardiotoxisch wirkt. Wichtigstes Beispiel ist Doxorubicin, das unter dem Namen Caelyx® als eine an Liposomen gebundene und mit Methoxypolyethylenglykol-Ketten beschichtete (d.h. pegylierte) Form existiert. Durch die Kopplung an Liposomen soll der Kapillaraustritt von Doxorubicin vorzugsweise in den abnormen Tumorgefässen und nicht an Orten mit engen Endothelverbindungen (wie z.B. im Herz) stattfinden, und die Pegylierung soll den Abbau durch das retikuloendotheliale System unterbinden. Die wenigen Studien, in denen liposomales und herkömmliches Doxorubicin miteinander verglichen worden sind, lassen vermuten, dass liposomales Doxorubicin bei ähnlicher Wirksamkeit weniger kardiotoxisch ist. Indessen verursacht es häufiger eine palmar-plantare Erythrodysästhesie («Hand-Fuss-Syndrom»). Rund zehnmal so teuer wie normales Doxorubicin, sollte die liposomale Form primär nur im Rahmen klinischer Studien verwendet werden oder wenn ein erhöhtes kardiales Risiko besteht.(11)
Möglicherweise hat eine prophylaktische Herzinsuffizienz- Behandlung mit ACE-Hemmern oder Betablockern eine schützende Wirkung; wenngleich noch keine schlüssigen Daten vorliegen, ist diese Massnahme gemäss kardiologischen Fachleuten in Erwägung zu ziehen. Unabhängig davon wird dazu geraten, in jedem Fall eine gute Blutdruckkontrolle anzustreben.
Trastuzumab
Trastuzumab (Herceptin®) ist ein monoklonaler Antikörper, der gegen HER-2 gerichtet ist. HER-2, ein transmembranärer Rezeptor aus der Gruppe der EGF-Rezeptoren («epidermal growth factor receptors»), wird in etwa 30% der Mammakarzinom- Zellen verstärkt exprimiert. Sowohl bei lokalen wie fortgeschrittenen HER-2-positiven Mammakarzinomen verbessert Trastuzumab die Prognose.
Dass Trastuzumab ein kardiotoxisches Potential besitzt, lässt sich davon ableiten, dass HER-2 für die embryonale Herzentwicklung und vermutlich auch bei der Anpassung des Herzens an Stressfaktoren wichtig ist. Bekräftigen liess sich dies durch mehrere Studien, in denen der Einsatz von Trastzumab bei der adjuvanten Therapie des lokalen Mammakarzinoms geprüft und das Auftreten von schwerwiegenden kardialen Nebenwirkungen (Linksherzinsuffizienz NYHA III oder IV, kardial bedingte Todesfälle) erfasst wurde. In diesen Untersuchungen hatte man die Chemotherapie – das am häufigsten verwendete Schema war die Kombination von Doxorubin und Cyclophosphamid, gefolgt von Paclitaxel – entweder mit Trastuzumab fortgesetzt oder ohne weitere Behandlung beendet. In zwei Studien wurde die kumulative 3-Jahresinzidenz der genannten kardialen Ereignisse ermittelt: in der Trastuzumab- Gruppe lag sie zwischen 2,8 und 4,1%, in der Kontrollgruppe zwischen 0,3 und 0,8%.(12,13) In einer dritten Studie gab man die Inzidenz nach einer medianen Beobachtungszeit von einem Jahr an: sie betrug 0,6% in der Trastuzumab-Gruppe und 0,06% in der Kontrollgruppe.(14) Es wurde auch eine Metaanalyse durchgeführt, die Daten derjenigen Studien zusammenfassend, in denen Trastzumab mindestens ein Jahr lang verabreicht worden war. Fälle von manifester Herzinsuffizienz (NYHA III oder IV) waren in der Trastuzumab-Gruppe um 1,6% häufiger als in der Kontrollgruppe, was einer «number needed to harm» (NNH) von 63 entspricht. Der Prozentsatz der Frauen, die von einer zwar asymptomatischen, aber dennoch als relevant eingestuften Abnahme der Auswurfsfraktion betroffen waren, lag in der Trastuzumab-Gruppe um 7,2% höher (NNH=14). Der Vorteil bei der Gesamtüberlebensrate, der sich mit Trastuzumab gewinnen liess, betrug 2,0%, was eine «number needed to treat» (NNT) von 50 bedeutet. Da sich NNT und die das Herzinsuffizienz-Risiko beschreibende NNH in einer ähnlichen Grössenordnung bewegen, ist die Kardiotoxizität von Trastuzumab nicht zu unterschätzen.(15) Aus diesem Grund sollte auch bei einer Trastuzumab-Behandlung eine regelmässige Kontrolle der Herzfunktion erfolgen.
Im Unterschied zu den Anthrazyklinen hängen die kardialen Nebenwirkungen von Trastuzumab nicht von der kumulativen Dosis ab und sind – soweit die noch relativ kurzen Beobachtungszeiten ein Urteil zulassen – mehrheitlich reversibel.(16)
Tyrosinkinasehemmer
Tyrosinkinasehemmer sind eine neue Gruppe von krebshemmenden Medikamenten, die ebenfalls Signalübertragungs- Wege blockieren, die über EGF-Rezeptoren vermittelt werden. Im Gegensatz zu den monoklonalen Antikörpern mit ähnlichen Angriffspunkten handelt es sich aber um kleine Moleküle. Wie Tabelle 1 zeigt, sind bei mehreren Tyrosinkinasehemmern kardiale Nebenwirkungen beschrieben worden.(17) Besonders häufig beobachtete man kardiovaskuläre Probleme bei Sunitinib (Sutent®) und Sorafenib (Nexavar®). Sunitinib, das beim fortgeschrittenen Nierenzellkarzinom und beim gastrointestinalen Stromatumor verwendet wird, führt in 14 bis 28% der Fälle zu einer Hypertonie und in 11 bis 14% der Fälle zu einer Verschlechterung der linksventrikulären Funktion.(18) Bei Sorafenib, eingesetzt beim Leber- und Nierenzellkarzinom, waren 17% der Behandelten von einer Hypertonie und 3% von einer kardialen Ischämie bzw. einem Myokardinfarkt betroffen.(19)
Schlussfolgerungen
Mit den verbesserten Überlebenschancen, die heutige Chemotherapien bei vielen Krebserkrankungen versprechen, ist vermehrt auch an mögliche Langzeitfolgen zu denken. Kardiotoxische Wirkungen verdienen dabei eine besondere Beachtung. Einerseits spielen kardiotoxische Substanzen eine grosse, bei manchen Tumoren wie zum Beispiel dem Mammakarzinom eine gar zunehmende Rolle, andererseits können kardiale Nebenwirkungen den aus onkologischer Sicht erzielten Therapieerfolg erheblich schmälern.
Klassische kardiotoxische Zytostatika sind die Anthrazykline, die eine dosisabhängige, kumulative Kardiotoxizität kennen. Eine kardiologische Überwachung während und nach einer Anthrazyklin-Behandlung ist deshalb obligat. Die mit den Anthrazyklinen gesammelten Erfahrungen und daraus abgeleiteten Vorsichtsmassnahmen können grösstenteils auch auf andere kardiotoxische Substanzen übertragen werden.
Bei der Vorbeugung kardiotoxischer Effekte fällt Hausärzten und -ärztinnen eine wichtige Rolle zu, indem sie als Risikofaktoren wirkende Herz-Kreislauf-Erkrankungen erfassen und behandeln.
Literatur
- 1) Pai VB, Nahata MC. Drug Saf 2000; 22: 263-302
- 2) Ng R et al. Semin Oncol 2006; 33: 2-14
- 3) Minotti G et al. Pharmacol Rev 2004; 56: 185-229
- 4) Swain SM et al. Cancer 2003; 97: 2869-79
- 5) van Dalen EC et al. Cochrane Database Syst Rev 2009; (4): CD005008
- 6) Gharib MI, Burnett AK. Eur J Heart Fail 2002; 4: 235-42
- 7) Pein F et al. Bull Cancer 2004; 91 (Suppl 3): 185-91
- 8) Gianni L et al. Cardiovasc Toxicol 2007; 7: 67-71
- 9) Altena R et al. Lancet Oncol 2009; 10: 391-9
- 10) van Dalen EC et al. Cochrane Database Syst Rev 2008; (2): CD003917
- 11) http://www.ema.europa.eu/humandocs/PDFs/EPAR/Caelyx/021296en6.pdf
- 12) Tan-Chiu E et al. J Clin Oncol 2005; 23: 7811-9
- 13) Perez EA et al. J Clin Oncol 2008; 26: 1231-8
- 14) Suter TM et al. J Clin Oncol 2007; 25: 3859-65
- 15) Bria E et al. Breast Cancer Res Treat 2008; 109: 231-9
- 16) Telli ML et al. J Clin Oncol 2007; 25: 3525-33
- 17) Zbinden S et al. Swiss Med Forum 2010; 10: 143-7
- 18) http://www.bccancer.bc.ca/NR/rdonlyres/EE7AE153-718A-4AB3-A01F- 66D6E49A8DC1/30569/sunitinib_monograph_30sep08_RW.pdf
- 19) http://www.bccancer.bc.ca/NR/rdonlyres/0784BED6-54F0-45E4-8C9D- 6FB74858FB6D/43575/Sorafenib_monograph_01jan10_R.pdf
Standpunkte und Meinungen
- Es gibt zu diesem Artikel keine Leserkommentare.
Copyright © 2024 Infomed-Verlags-AG
PK697
Verwandte Artikel
LoginGratisbuch bei einem Neuabo!
pharma-kritik abonnieren
-
Jahrgang 45 / 2023
Jahrgang 44 / 2022
Jahrgang 43 / 2021
Jahrgang 42 / 2020
Jahrgang 41 / 2019
Jahrgang 40 / 2018
Jahrgang 39 / 2017
Jahrgang 38 / 2016
Jahrgang 37 / 2015
Jahrgang 36 / 2014
Jahrgang 35 / 2013
Jahrgang 34 / 2012
Jahrgang 33 / 2011
Jahrgang 32 / 2010
Jahrgang 31 / 2009
Jahrgang 30 / 2008
Jahrgang 29 / 2007
Jahrgang 28 / 2006
Jahrgang 27 / 2005
Jahrgang 26 / 2004
Jahrgang 25 / 2003
Jahrgang 24 / 2002
Jahrgang 23 / 2001
Jahrgang 22 / 2000
Jahrgang 21 / 1999
Jahrgang 20 / 1998
Jahrgang 19 / 1997
Jahrgang 18 / 1996
Jahrgang 17 / 1995
Jahrgang 16 / 1994
Jahrgang 15 / 1993
Jahrgang 14 / 1992
Jahrgang 13 / 1991
Jahrgang 12 / 1990
Jahrgang 11 / 1989
Jahrgang 10 / 1988
Kennen Sie "100 wichtige Medikamente" schon?
Die Liste der 100 Medikamente sehen Sie auf der Startseite von 100 Medikamente.